北柴胡 (Bupleurum chinense DC.) 为伞形科柴胡属植物,是 《中华人民共和国药典》 (2010年版) 规定的药用柴胡基源植物之一,以根入药,具有解表退热、疏肝解郁、升举阳气功效。主要药效成分包括柴胡皂苷、挥发油、类黄酮和多糖等[1]。1977年Acketmann首先成功的用发根农杆菌 (Agrobacterium rhizogenes) 侵染高等植物获得毛状根[2],人们就开始意识到毛状根培养对于规模化生产和调控根部药材药效成分合成的广阔前景。以往研究表明诱导产生的毛状根不但具有生长迅速、次生代谢物质合成能力强的优点,而且生产能力稳定、不需外源激素,这些特点都有利于天然药物的开发和利用[3, 4, 5]。目前,人参[6]、丹参[7]、桑树[8]、高山红景天[9]、新疆雪莲[10]、长春花[11]、黄芩[12]等多种药用植物建立了毛状根诱导和培养体系,通过不同毛状根根系筛选、培养条件优化等手段以获得更高产量和药效成分含量。发根农杆菌介导的药用植物遗传转化已应用于植物次生代谢产物的生产[4]。利用Ri质粒,通过发根农杆菌介导的遗传转化,还可将外源基因导入诱导产生的毛状根中[13, 14, 15, 16]。由此,可以通过转化药效成分合成与调控相关基因,在更广尺度上建立更有价值的毛状根培养体系。这一体系也是研究植物基因功能的有效手段[17, 18, 19, 20]。柴胡属中高氏柴胡 (B. kaoi) 和三岛柴胡 (B. falcatum) 的毛状根诱导可见报道[21, 22],但未见毛状根再生植株的报道。本研究从菌种种类、外殖体类型、侵染方式、侵染时间等多种毛状根诱导条件出发,摸索诱导北柴胡毛状根zui佳条件。随后,对毛状根再生植株培养条件进行了筛选,从而建立了稳定的柴胡毛状根诱导和植株再生体系。为柴胡毛状根的大规模培养和产业化开发奠定了基础,也为柴胡次生代谢的基础理论研究,如药效成分生物合成关键酶基因、代谢调控基因的功能分析、性状的基因改良等奠定了基础。
材料与方法
菌株和植物材料
发根农杆菌 (Agrobacterium rhizogenes) 菌株ACCC10060为中国中医科学院中药研究所崔光红老师馈赠,菌株ATCC11325、A4和K599为大连工业大学张宗申老师馈赠,菌株R1601为实验室刘小丽博士后保存。含有外源质粒的A4菌株的制备: 首先参考文献[9]制备A4菌株感受态细胞,然后利用热击转化法将质粒pK7GWIWG2D (II) (带有绿色荧光蛋白GFP基因,购自比利时VIB生命科学研究所) 导入A4感受态细胞,于附加利福平和壮观霉素的YEB[23]培养基上筛选,利用GFP特异引物PCR鉴定,选择阳性克隆A4 (pK7GWIWG2D (II) )。植物材料为本课题组选育的北柴胡新品种“中柴2号”。
无菌苗培养
取“中柴2号”品种种子,自来水浸泡24 h,其间每间隔4 h换一次水,75% 乙醇浸泡15 min,无菌水冲洗3次,10﹪次氯酸钠浸泡30 min,无菌水冲洗5~7次,无菌滤纸吸干表面水分,接种于无激素MS[23]固体培养基上,置于25 ℃条件下暗培养15天左右,种子开始萌发,转入8 h/16 h光照和黑暗交替条件下培养1个月得到无菌苗。剪取幼苗根、叶片和叶基部,切成0.5~1 cm的切段,接种于愈伤诱导固体培养基 (MS + NAA 6 mg·L-1 + 蔗糖30 g·L-1) 中,25 ℃暗培养,诱导愈伤组织形成。选取结实的愈伤组织接种于分化培养基 (MS + KT 0.5 mg·L-1 + 蔗糖30 g·L-1) 中,分化成苗。愈伤组织可不断继代培养,因此可分批次诱导分化成苗,供后续毛状根诱导用。
发根农杆菌活化
从 -80 ℃冰箱取出保存的菌种,划线接种于含相应抗生素的YEB培养基上,28 ℃暗培养2天,挑取单菌落,于YEB液体培养基中 (添加相对应的抗生素) 28 ℃、180 r·min-1振荡暗培养至OD600为1~1.2,再次按1∶100稀释菌液后摇培OD600至0.6~0.8,5 000 r·min-1离心10 min,收集菌体,用等体积的B5液体培养基重悬菌体,供侵染用。
毛状根诱导
剪取北柴胡无菌苗不同部位,包括叶片、叶基部、茎基部和根作为供侵染的外殖体,置于无激素B5培养基上预培养1~3天。选取发根农杆菌ACCC10060、ATCC11325、A4、K599和R1601作为本实验供试菌种。将预培养的外殖体置于B5[24]培养基悬浮的菌液 [附加200 μmol·L-1乙酰丁香酮(AS)] 中浸染,分别采用物理划伤处理、共摇培处理、超声波处理和菌液浸泡的侵染方式,侵染时间设为15、20和25 min 3个梯度。侵染后的外殖体用无菌滤纸吸干表面多余菌液,转入不同共培养固体培养基上,包括B5 + AS 200 μmol·L-1、MS + NAA 6 mg·L-1 + AS 200 μmol·L-1、B5和MS + NAA 6 mg·L-1,黑暗中共培养3天,在添加500 mg·L-1头孢霉素的B5液体培养基中清洗后,用无菌滤纸吸干表面液体,转入不同除菌固体培养基 (B5 + Cef 500 μmol·L-1和MS + NAA 6 mg·L-1 + Cef 500 μmol·L-1) 上,置于25 ℃暗室 中诱导发根。待发出的根长至2~3 cm,一部分直接转入B5液体培养基中摇培; 另一部分将其切下转接于B5 + 0.15 mg·L-1 IBA的固体培养基上培养4周 左右,选择生长迅速、长2~3 cm的根切下,再转入B5液体培养基,25 ℃、90 r·min-1暗培养。剪取北柴胡正常无菌苗的根,与毛状根液体培养条件相同,做为对照。
毛状根再生植株的获得
将毛状根液体培养时,产生的黄化小苗直接转入固体MS基本培养基上,于光下培养即可成苗。另外毛状根液体摇培时,产生的类愈伤组织,将其置于7种不同分化培养基 (表 1) 中进行筛选,诱导成苗。当小苗长至3~5 cm,移栽至基质 (蛭石∶沙土=1∶1),放入温室,观察生长情况。
点击查看表格内容
Table 1 List of media screened for plant regeneration from hairy root
毛状根的检测
根据文献[24],合成引物rolC-F: 5'-ATGGCGGAATTTGACCTATG-3'; rolC-R: 5'-TTAG TTCCATCTGCCCATCC-3',PCR扩增发根农杆菌Ri质粒上T-DNA所含有的rolC基因,证实是否获得毛状根; 根据质粒pK7GWIWG2D (II) 上GFP基因序列设计引物 (GFP-F: 5'-CGACGTAAACGGCCACA AGTTCAGCG-3'; GFP-R: 5'-GCCGTTCTTCTGCTT GTCGGCCATGATAT-3'),PCR扩增GFP基因,证实是否可将外源基因转入毛状根。引物均由上海生工 生物工程有限公司合成。取除菌完全毛状根及其再 生植株和北柴胡试管苗及其正常根组织各约0.1 g,用新型植物基因组DNA提取试剂盒 (TINAGEN公司) 提取DNA。PCR反应总体积25 μL,包括ddH2O 10 μL,Premix PrimeSTAR Hs 12.5 μL (TaKaRa公司),引物各0.5 μL (10 μmol·L-1),模板DNA 30 ng。PCR反应程序: ① 94 ℃预变性5 min; 98 ℃ 15 s,56 ℃ 15 s,72 ℃ 1 min,40循环; zui后72 ℃延伸10 min; ② 94 ℃预变性5 min; 98 ℃ 15 s,66 ℃ 15 s,72 ℃ 1 min,30循环; zui后72 ℃延伸10 min。rolC基因扩增采用程序①,GFP基因扩增采用程序②。扩增产物用1.0% 琼脂糖凝胶电泳,EB 染色,紫外灯下观察。另外,将转化质粒pK7GWIWG2D (II) 的发根农杆菌A4诱导的毛状根及其再生植株,置于转基因生物观测镜DFP-1 (Nightsea) 和Leica DM4000 B LED显微镜观察。

结果与分析
1 毛状根的诱导和培养
发根农杆菌A4、R1601、ATCC11325、ACCC10060均可诱导出毛状根,其中发根农杆菌A4诱导发根率显著高于其他3种,约10% 左右,zui低的是ATCC11325,500个外殖体中只有一个发根。将叶片、叶基部、茎基部和根4种不同外殖体用同种菌液同样条件诱导毛状根,结果显示叶基部的诱导率zui高,叶片次之。另 外,外殖体的大小也影响诱导成功率,长1~1.5 cm、宽0.5 cm的诱导成功率较高,体积过小的外殖体更容易被菌液或抗生素杀死而不会诱导出毛状根。以物理划伤处理、共摇培处理、超声波处理、菌液浸泡4种不同的侵染方法在相同诱导条件下诱导北柴胡毛状根,结果显示只有菌液浸泡的方法有效。不同侵染时间也对诱导率有一定的影响,设置15、20、25 min 3种不同的侵染时间,其中20 min侵染时效果zui佳; 25 min侵染时,后续除菌困难,外殖体褐化严重。
外殖体除菌培养10天后出现发根现象。在B5 + AS 200 μmol·L-1、MS + NAA 6 mg·L-1 + AS 200 μmol·L-1、B5、MS + NAA 6 mg·L-1 4种共培养基条件下诱导北柴胡毛状根,结果显示共培养时添加乙酰丁香酮的诱导率较高。另外,在B5 + AS 200 μmol·L-1条件下,叶片基部直接发根,每个叶片基部通常发出一条或几条根 (图 1-a、b),经rolC基因扩增证实,如此发出的根通常均为毛状根。MS + NAA 6 mg·L-1 + AS 200 μmol·L-1条件下,先在叶片表面长出愈伤,而后通过愈伤发出较多条根 (图 1-c),rolC基因扩增证实,其中有不定根,也有毛状根。
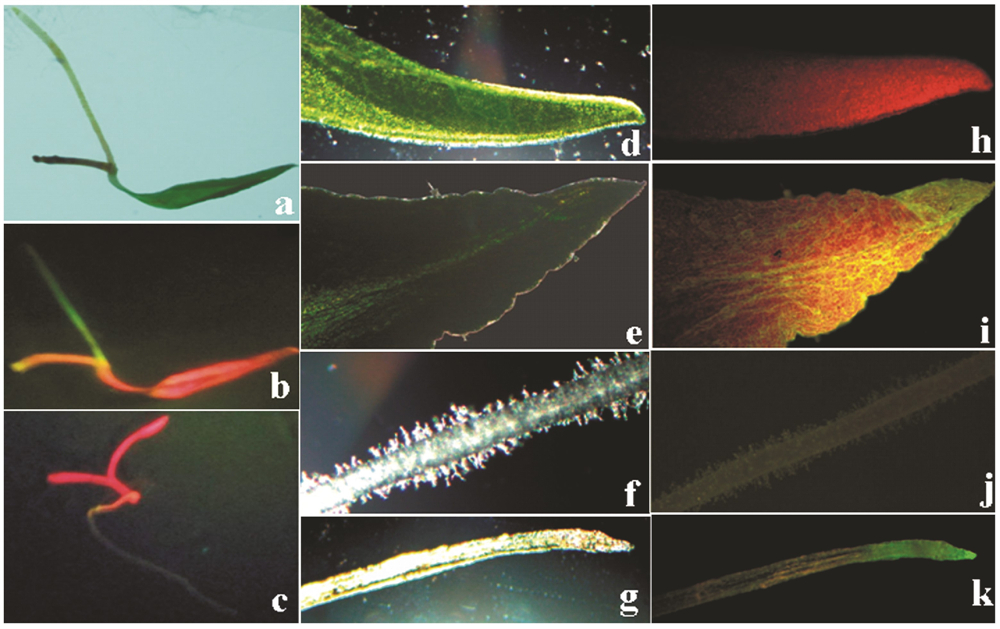 待外殖体上发出的根长至3 cm左右,一部分直接移入无激素B5液体培养基培养,但生长缓慢,直至培养12周后,毛状根才大量生长 (如图 1-f)。因此将另一部分外殖体上发出的根剪取下来移至B5 + IBA 0.15 mol·L-1培养基上,培养至2周,毛状根分出许多侧根 (如图 1-d),然后将其移入无激素B5液体培养基培养,培养6周后 (如图 1-e),毛状根大量生长。有些外殖体发出的根,尤其是通过愈伤发出的根,从外殖体上剪下置于无激素培养基上培养时,开始褐化,不再继续生长,也不能产生侧根,应为不定根。
待外殖体上发出的根长至3 cm左右,一部分直接移入无激素B5液体培养基培养,但生长缓慢,直至培养12周后,毛状根才大量生长 (如图 1-f)。因此将另一部分外殖体上发出的根剪取下来移至B5 + IBA 0.15 mol·L-1培养基上,培养至2周,毛状根分出许多侧根 (如图 1-d),然后将其移入无激素B5液体培养基培养,培养6周后 (如图 1-e),毛状根大量生长。有些外殖体发出的根,尤其是通过愈伤发出的根,从外殖体上剪下置于无激素培养基上培养时,开始褐化,不再继续生长,也不能产生侧根,应为不定根。
综合北柴胡诱导毛状根的zui佳条件为: 发根农杆菌A4侵染北柴胡无菌苗叶基部,使用菌液浸泡方法侵染20 min,置于B5 + AS 200 μmol·L-1或MS + NAA 6 mg·L-1 + AS 200 μmol·L-1上共培养3天,再转入添加除菌剂的同样培养基上诱导发根,发出的根先在有激素培养基上短期培养后,再转入无激素培养液内大量摇培。
2 毛状根的植株再生
诱导产生的毛状根在液体摇培阶段伴随脱落现象,有些毛状根根系脱落类似愈伤的组织小块,继续在液体中培养,毛状根本身会表现出生长缓慢、且逐渐老化的现象 (图 2-a、b)。将脱落下的类愈伤组织,置于固体培养基上诱导成苗,共设置了7种含有不同激素的培养基进行筛选。结果7种培养基均可使类愈伤组织再生成苗,其中5号培养基生成的幼苗生长状态zui佳 (图 2-c)。将生成的再生幼苗转置MS基本培养基中继续培养。培养过程中,在幼苗的根茎部位还可出现分化芽 (图 2-d),不定芽仍可继续长成完整植株,由此得到大量毛状根再生植株。另外还有些毛状根根系直接脱落幼苗,由于液体摇培是处于黑暗中,小叶片黄白色 (图 2-e、f),将其转入固体MS基本培养基上,置于光下培养,白化幼苗继续生长,叶片转为绿色。幼苗长到一定大小后,其根上又会脱落下小幼苗,先是长出小侧根,随后在侧根与主根接合处侧根基部长出两片小叶片 (图 2-g)。将再生植株移栽至基质 (蛭石-沙土=1∶1) 中,再生植株可正常生长,与正常播种的种子植株没有明显差别。另外,将再生植株的根剪下放入无激素液体B5培养基中摇培,仍可大量发根,表现出典型的毛状根特性。
3 柴胡毛状根rolC基因和再生植株GFP基因PCR检测及GFP绿色荧光检测
取A4 (pK7GWIWG2D (II) ) 诱导产生的毛状根及其再生植株提取基因组DNA,分别进行rolC基因和GFP基因的PCR扩增。PCR产物经琼脂糖凝胶电泳检测,获得预期条带,经测序验证为rolC基因序列 (图 3) 和GFP基因序列 (图 4)。证实获得了毛状根,而且外源基因也已成功整合到柴胡基因组中。另外,使用转基因生物观测镜观察到了由叶片上诱导发出的带绿色荧光的毛状根 (图 5-b)。利用显微镜也观察到了毛状根再生植株的叶片和根中的绿色荧光 (图 5-i、k)。
讨论
发根农杆菌诱导产生毛状根及其植株再生体系已在多种植物中得到研究。但是,不同植物诱导条件和植株再生条件都有很大差别,有些植物的发根难以诱导,对于每种植物的诱导条件没有固定模式可循,需要针对研究的植物尝试摸索出适宜的诱导培养条件[3, 4, 5]。北柴胡毛状根诱导和植株再生体系还未见报道。与北柴胡同属的其他种,如台湾产高氏柴胡 (B. kaoi) 和韩国三岛柴胡 (B. falcatum) 的毛状根研究有报道[21, 22],但未见柴胡毛状根再生植株的报道。三岛柴胡毛状根诱导采用A4菌株,但具体诱导率等情况未见详细报道。高氏柴胡毛状根诱导是将叶片 基部于无激素B5培养基上预培养5天,采用R1601侵染5 min后共培养3天,再进行除菌培养,获得毛状根[21]。本实验也采用了R1601,但诱导率不及A4。与高氏柴胡研究结果一致的是叶片基部较其他部位如叶片、茎等更容易发根。本实验从菌株种类、外殖体种类、侵染方式、侵染时间和共培养培养基种类等诱导条件出发,筛选到了能够诱导北柴胡毛状根形成的综合条件,但诱导率在10% 左右。高氏柴胡毛
状根诱导研究中对影响毛状根诱导和培养的各种因素进行了细致比较,结果显示尽管采用根和茎基部为外殖体时,发根率可达80% 以上,但是未经农杆菌侵染的对照也可形成近 的发根,表明如此发出的根绝大部分可能为不定根,从中鉴定筛选出毛状根较为困难。所以不建议使用根和茎基部作为柴胡 毛状根诱导的外殖体。除此之外,高氏柴胡毛状根诱导率与本研究中北柴胡毛状根诱导率基本一致,也在10% 左右。相比其他植物毛状根诱导率,有些可达60% 左右[7, 21, 22],也有些毛状根诱导难以成功[25],柴胡毛状根诱导率是否还可提高有待继续从菌株和诱导条件等方面摸索。柴胡毛状根的规模化生产条件也还需要进一步探索研究。另外,实验中获得了转化有外源GFP基因的毛状根再生植株,这一体系将应用于柴胡重要基因的功能研究。
孙晶1,2, 徐洁森1,3, 赵立子1,3, 魏建和1,3, 杨洪一2, 隋春1,3通讯作者 cscui@implad.ac.cn
1. 中国医学科学院、北京协和医学院药用植物研究所, 北京 100193;
2. 东北林业大学生命科学院, 黑龙江 哈尔滨 150040;
3. 中草药物质基础与资源利用教育部重点实验室, 北京 100193








 添加微信咨询!
添加微信咨询!