变性RNA在膜上的转移和固定
实验方法原理:
多数情况下,为检测特定的靶 mRNA,需先将 RNA 通过琼脂糖电泳分离后,再从胶上转移到二维支持物上,(通常用尼龙膜),再与持异的标记探针杂交。正如在 Nonhem 杂交中讨论的情况,实验者可采用多种试剂和膜用于 RNA 的转移以达到 RNA 和膜紧密结合的效果。我们认为,zui佳的 Nonhern 印迹可通过在中性或碱性条件下将 RNA 从胶上转移到尼龙膜上。
实验材料:RNA 样品
试剂、试剂盒:乙酸铵 亚甲蓝溶液 浸润液 SSC 转移缓冲液
仪器、耗材:印迹滤纸、紫外交联仪、玻璃皿、尼龙膜、有机玻璃或玻璃板、裁纸刀片、厚印迹滤纸、可见光盒、重物、黄色滤光片
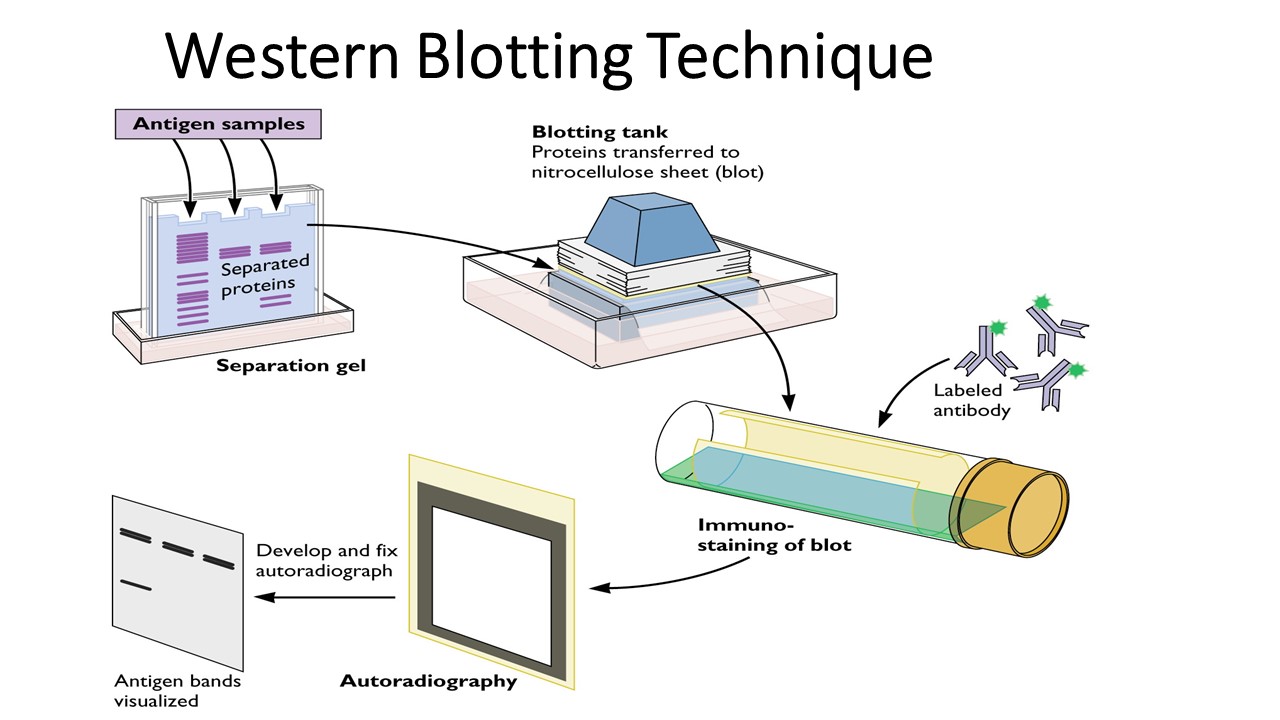
实验步骤
一、材料
1. 缓冲液及溶液
含 0.5 μg/ml 溴化乙锭的 0.1 mol/L 乙酸铵
亚甲蓝溶液(0.02% 亚甲蓝(Sigma,89% 纯度)溶于 0.3 mol/L 乙酸钠(pH 5.5) )
浸润液
含 1% SDS (m/V) 的 0.2XSSC
20X SSC
转移缓冲液
2. 核酸和核糖体
RNA 样品,琼脂糖电泳分离
3. 专用设备
印迹滤纸(Schleicher 和 Schuell GB002 或 Sigma P 9039)
交联设备(如:Stratalinker, Stratagene; GS Gene Linker, Bio-Rad)或微波炉或真空炉
烤干的玻璃皿
带正电荷或不带电荷的尼龙膜
转移过程中用于支持胶的有机玻璃或玻璃板
裁纸刀片
厚印迹滤纸(Whatman 3 MM/L, Schleicher 和 Schuell GB004, 或 Sigma Quick-Daaaraw)
可见光盒
400 g 的重物
照相用黄色滤光片
二、方法
转移胶的制备
1. (可选)将胶浸入相应的浸泡液中,部分水解经琼脂糖分离的 RNA 样品的操作如下。将电泳后的胶经 NaOH 部分水解可提高 RNA 转移至带正电荷或不带电荷的尼龙膜的转移效率,该处理方法尤其适于琼脂糖浓度>1%、凝胶厚度>0.5 cm 或待分析的 RNA>2.5kb 的情祝。
(1) 若转移至不带电荷的尼龙膜
① 用 DEPC 处理的水淋洗胶
② 将胶浸入 5 倍胶体积的 0.05 mol/L NaOH 中 20 min
③ 将胶转入 10 倍体积的 20x SSC 中 40 min
④ 直接进入步骤 2,迅速将部分水解的 RNA 通过毛细管转移到不带电荷的尼龙膜
(2) 若转移至带电荷的尼龙膜
① 用 DEPC 处理的水淋洗胶
② 将胶浸入 5 倍体积的 0.01 mol/L NaOH-3 mol/L NaCl 中 20 min
③ 直接进入步骤 2,迅速将部分水解的 RNA 通过毛细管转移到带正电荷的尼龙膜
2. 将凝胶转移至一个玻璃干烤皿内,用锋利的刀片修去凝胶的无用部分以保证转移过程中胶与膜对齐,在凝胶的左上角切取一角以作为下列操作过程中凝胶方位的标记。
3. 用长和宽均大于凝胶的一块 Plexiglas 或玻璃板作为平台,将其放入大干烤皿内,上面放一张滤纸。
4. 于干烤皿内倒入相应的转移缓冲液(带正电荷的膜用 0.01 moI/L NaOH-3 mol/L NaCl,不带电荷的膜用 20X SSC) 直至液面略低于平台表面,当平台上方的滤纸完全湿透后,用玻棒或移液管赶走的气泡。
转移膜的准备
5. 用新的解剖刀或切纸刀裁一张长宽均大于胶 1 mm 的尼龙膜。
6. 将尼龙膜漂浮在去离子水表面直至滤膜从下往上全部湿透,然后将膜浸入 10X SSC 中至少 5 min,用干净的解剖刀片切去滤膜一角,使其与凝胶的切角相对应。
转移系统的安装和 RNA 的转移
7. 将胶倒转后置于平台上滤纸的中央,确保厚滤纸和胶之间没有气泡滞留。
8. 用 Saran 保鲜膜或 Parafilm 膜围绕凝胶周边,而不是覆盖凝胶。
9. 用转移缓冲液浸湿胶(见第 4 步),在凝胶上方放置湿润的尼龙膜,并使两者的切角相重叠,滤膜的一条边缘应刚好超过凝胶上部加样孔一线的边缘。
10. 用相应的转移缓冲液浸湿两张与胶大小一致的滤纸,放于湿的尼龙膜上,用玻棒赶走的气泡。
11. 剪一叠 5~8 cm 厚,略小于滤纸的纸巾,放于滤纸上,于纸巾上放一块玻璃板,然后压上 400 g 重的重物。
12. 上行流路的 RNA 转移在中性转移缓冲液中的转移时间不超过 4 h, 在碱性转移缓冲液中不超过 1 h。
13. 拆除毛细管转移系统,用圆珠笔在膜上标出凝胶加样孔的位置,将膜转移至含 300 ml 6X SSC 的玻璃平皿中,然后将平皿放置摇床,室温 23℃ 轻摇 5 min。
14. 从 6X SSC 溶液中取出凝胶,将多余的液体沥干后,将膜的 RNA 面向上放置于干的滤纸上数分钟。
RNA 的染色以及 RNA 在膜上的固定
染色和固定的步骤根据转移类型、膜的类型以及固定方法不同而有所不同。由于在碱性缓冲液中 RNA 与带正电的尼龙膜共价结合,故在染色前勿需将 RNA 固定在膜上,而在中性缓冲液中转移至不带电荷的尼龙膜上的 RNA,经过染色后,可通过真空干烤 或在微波炉加热而固定在膜上。若 RNA 通过紫外照射下交联至膜上,则 RNA 的染色应在固定之后。
转移至尼龙膜的 RNA 可通过与亚甲蓝染色得以鉴定(Herrin and Schmidt 1988), 这一简单方法可用于 RNA 浓度监测、转移效率的估计、主要 RNA (通常是 rRNA) 在膜上位置的估计。如果 RNA 是通过紫外交联固定,则转至步骤 16。
15. 膜的染色。
(1) 将湿膜转移至含亚甲蓝溶液的玻璃器皿中染色,染色时间视能鉴定 rRNA 而定 ( 3~5 min)。
(2) 在可见光下用黄色滤光片对染色的膜照像。
(3) 照像后,将膜放入 0.2X SSC 和 1%(m/V)SDS 中室温脱色 15 min。
16. RNA 固定在不带电荷的尼龙膜上。
(1) 干燥固定
① 待膜在空气中晾干后,将干燥的膜夹在两张滤纸间,80℃ 真空炉干烤 2 h。
② 或将湿膜置于干的滤纸上,微波炉里(750~900 W) 以zui大功率加热 2~3 min。
(2) 紫外照射交联固定
① 将湿润的未染色的尼龙膜置于一张干的滤纸上,在波长 254 nm 处按照 1.5 J/cm2 的剂量照射 1 min 45s。
② 紫外照射后,参照步骤 15 用亚甲蓝染色。








 添加微信咨询!
添加微信咨询!